
毕业后医学教育网
上海市

时间:2020-06-22 09:14 来源:上海市 作者:李思玥 通讯员:任羿诚
科研动态
复旦大学附属华山医院康复医学科


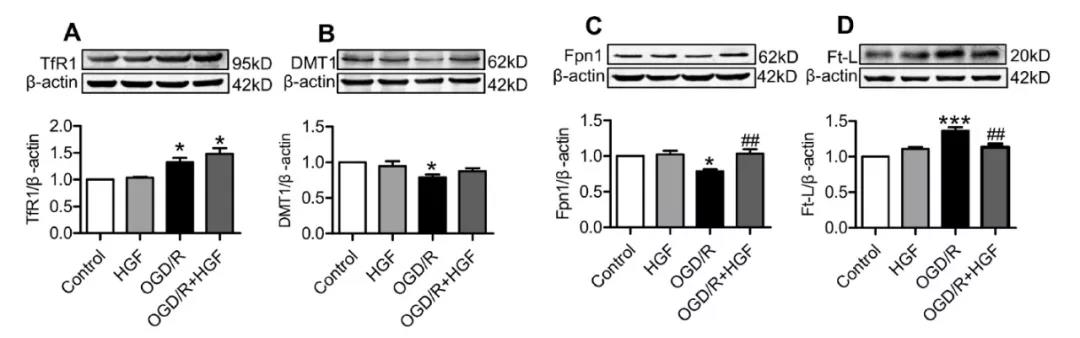
1. OGD/R环境下,HGF预处理增强PC 12细胞活力,且能上调Fpn1、下调Ft-L,但对TfR1和DMT1的表达没有明显影响。
用40 ng/ml浓度的HGF预处理PC12细胞一小时后暴露于OGD 6小时/ R 24小时环境下,细胞活力的增强最为明显。我们也发现,TfR1(图2A)和DMT1(图2B)的表达高于未使用HGF的组别,但差异不显著。而HGF预处理后,Fpn1(图2C)在 OGD/R环境下的表达较未处理组相比明显降低,表明HGF预处理可以逆转OGD/R对Fpn1的抑制作用。而HGF + OGD/R联合处理的细胞中Ft-L(图2D)的含量明显低于仅用OGD/R处理的细胞,这表明HGF能够降低OGD/R导致的PC12细胞内铁的储存含量。
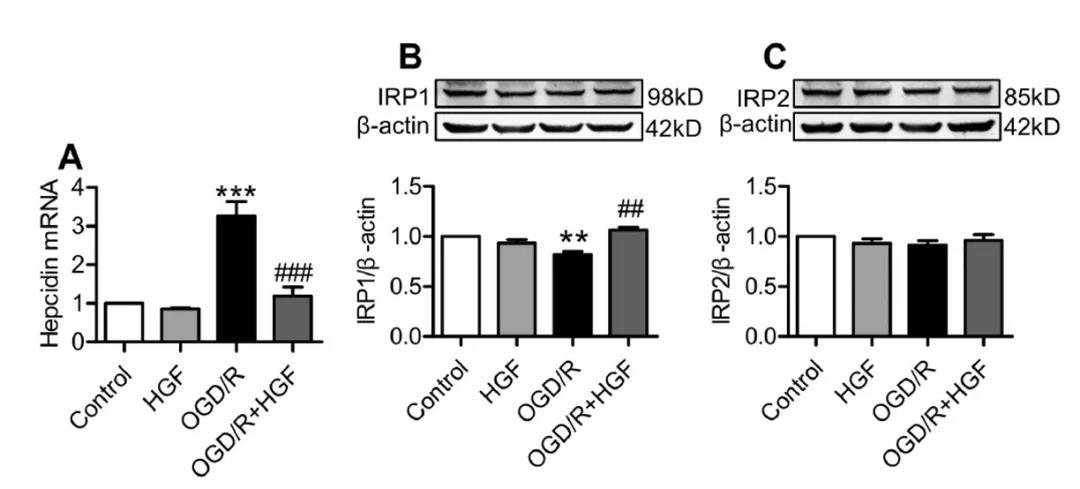
2. OGD/R环境下,HGF预处理PC 12细胞能下调hepcidin mRNA和上调IRP1蛋白表达。
哺乳动物的铁代谢或铁转运和贮铁蛋白的表达受IRPs及铁调素系统地调控。因此,我们进一步研究了在OGD/R环境下,HGF如何影响铁转运和贮铁蛋白的表达。在OGD/R环境下,HGF预处理较未处理相比, IRP2的表达没有显着差异,这表明HGF对缺氧条件下IRP2的表达没有影响。但是,OGD/R条件下Hepcidin mRNA的表达和IRP1蛋白的减少,用HGF + OGD/R共同处理的细胞中hepcidin mRNA的表达明显较低(图3A),而IRP1蛋白表达则较高(图3B),而与仅用HGF处理的常氧细胞相比,无明显差异。这表明,HGF可以逆转OGD / R对铁调素和IRP1的影响。
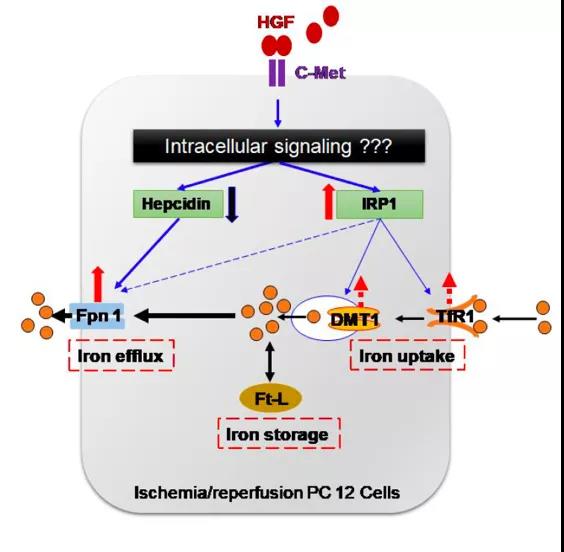
HGF与其受体(c-Met)的结合激活了细胞内信号传导途径。激活的信号通路诱导铁调素hepcidin显著减少、IRP1表达增加。Fpn1的表达受铁调素和IRP的控制;然而,铁调素可能在OGD/R条件下起主导作用。因此,Fpn1表达的增加主要归因于HGF诱导的hepcidin表达的下调。Fpn1表达的增加和Fpn1介导的铁从细胞中的释放会导致Ft-L含量的显著降低。TfR1和DMT1表达的轻微增加可能与IRP1表达的增加有关。而HGF与c-Met受体结合激活的细胞内信号传导途径尚不清楚,因此需要对此进行进一步的研究。
讨论
■■■■
吴毅教授点评:
■■■■
作者简介
CONTACT US
李思玥 复旦大学附属华山医院2018级康复医学与理疗学专业博士研究生,师从吴毅教授。主要研究方向:损伤脑的临床和基础研究。目前以第一作者发表SCI论文4篇。